Règlement sur les aliments et drogues (C.R.C., ch. 870)
Texte complet :
- HTMLTexte complet : Règlement sur les aliments et drogues (Boutons d’accessibilité disponibles) |
- XMLTexte complet : Règlement sur les aliments et drogues [4933 KB] |
- PDFTexte complet : Règlement sur les aliments et drogues [12999 KB]
Règlement à jour 2024-05-01; dernière modification 2023-11-24 Versions antérieures
ANNEXE K.1(paragraphes B.01.350(1), B.01.351(1) et (5))
Symboles nutritionnels et modèles
Modèle horizontal unilingue
1(FH)  | 1(AH) 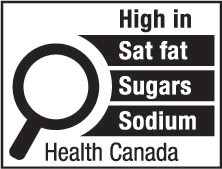 |
2(FH)  | 2(AH)  |
3(FH)  | 3(AH) 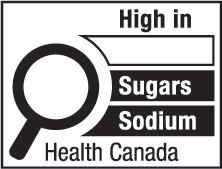 |
4(FH)  | 4(AH) 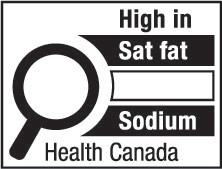 |
5(FH)  | 5(AH)  |
6(FH) 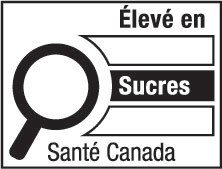 | 6(AH) 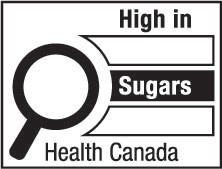 |
7(FH)  | 7(AH) 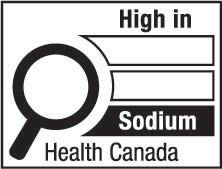 |
8(FH)  | 8(AH)  |
9(FH)  | 9(AH) 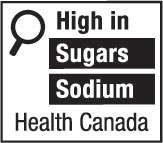 |
10(FH)  | 10(AH) 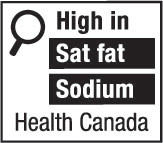 |
11(FH)  | 11(AH)  |
12(FH)  | 12(AH)  |
13(FH)  | 13(AH)  |
Modèle vertical unilingue
1(FV)  | 1(AV)  |
2(FV)  | 2(AV)  |
3(FV)  | 3(AV)  |
4(FV)  | 4(AV)  |
5(FV)  | 5(AV)  |
6(FV)  | 6(AV)  |
7(FV)  | 7(AV)  |
8(FV)  | 8(AV)  |
9(FV)  | 9(AV)  |
10(FV)  | 10(AV)  |
11(FV)  | 11(AV)  |
12(FV)  | 12(AV)  |
13(FV)  | 13(AV)  |
Modèle horizontal bilingue
1(HB)

2(HB)

3(HB)

4(HB)

5(HB)

6(HB)

7(HB)

8(HB)

9(HB)

10(HB)

11(HB)

12(HB)

13(HB)

Modèle vertical bilingue
1(VB)

2(VB)

3(VB)

4(VB)

5(VB)

6(VB)
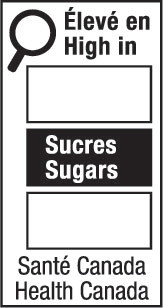
7(VB)

8(VB)

9(VB)

10(VB)

11(VB)

12(VB)

13(VB)

- Date de modification :